- 1.80 MB
- 2022-04-29 13:58:30 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'中国仿制药产业发展的机遇和挑战•仿制药品与被仿制药品(原研药)具有同样的活性成份,给药途径,剂型,规格和相同的疗效。但其价格是原研药的30%,甚至更低。对于国外社会福利好的国国外仿制药现状家,扶持仿制药产业是节约国家政府开支很重要的一个举措:在美国,2009仿制药占处方药市场比例70%以上,处于仿制药消费大国之首(产品从150个国家进口);德国、英国的仿制药也已超过50%•国内老龄化,城镇化加速造成的医改和对仿制药的需求急剧增加中国仿制药产业•10年内专利药集中到期造成了仿制药的战略机遇发展的机遇•部分企业已经开始国际标准的注册和海外战略,取得了积极进展•整体上研发技术水平低•缺乏仿制药制剂的国际注册经验,制剂产品很少进入发达国家市场,,国际竞争力中国仿制药产业发不强展的挑战•缺乏国际标准和通行质量规范,质量管理的理念和管理水平与国际水平尚有明显差距,造成了产品国际竞争能力不足221
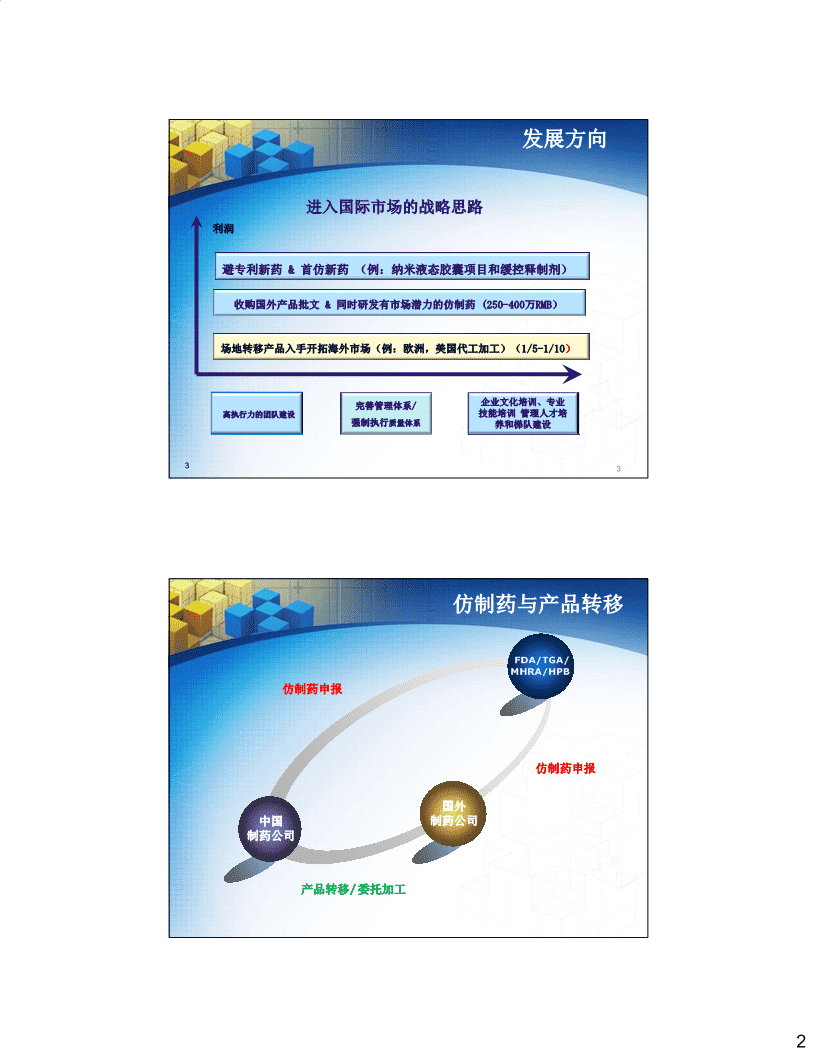
发展方向进入国际市场的战略思路利润避专利新药&首仿新药(例:纳米液态胶囊项目和缓控释制剂)收购国外产品批文&同时研发有市场潜力的仿制药(250-400万RMB)场地转移产品入手开拓海外市场(例:欧洲,美国代工加工)(1/5-1/10)企业文化培训、专业完善管理体系/高执行力的团队建设技能培训管理人才培强制执行质量体系养和梯队建设33仿制药与产品转移FDA/TGA/MHRA/HPB仿制药申报仿制药申报国外中国制药公司制药公司产品转移/委托加工2
仿制药与转移产品仿制药转移产品有DMF或CEP,或与厂家原料药已注册批准过的有DMF或CEP文号一起申报配方×√申报批(1-2批,转移批(2-3批,fullsize),批准后批量/批次1/10),不能出售可以出售BE√(10-80万美金/规格)×稳定性√(3或6个月加速)√(允许批准后递交)包装形式,小盒说明原研药客户注册产品书,铝箔成本250-400万RMB1/5或1/103-6个月(短平快)(适应国际市场对时间24-36个月仿制药GMP要求)产品转移•短平快,间接进入国际市场•积积册累国际注册经验,提高国际提高竞争的能力•积累研发管理经验,提高研发技术,产品质量和生产质量管优点理水平•建立符合国际标准的研发实验室,打造一支过硬的研发团队,培养一批高水平的科研人员缺点•利润低3
内容1中国仿制药行业发展的机遇和挑战2场地/产品/技术转移流程3质量源于设计4设备清洁验证5准备GMP文件的现场检查场地/产品/技术转移流程立项原辅料确认项目成本核算项目计划书包装形式和包材确认技术转移资料技术可行性评估成立项目小组模具确认确定责任人试剂,标样,柱子确认中试,验证方案中试批生产分析方法,标准,客户批准采购验证批生产分析方法转移方案,稳定性草案QC放行递交申报材料cGMP审查GMP证书稳定性研究办理委托加工手产品出口册4
说明∑原料::采用MA上所列的厂家(大变更,需6-9个月,或9-12个月,场地转移只需3-6个月)∑辅料:可采用国产或印度的便宜,但符合NF或BP/EP标准的∑批量的确定要根据厂家设备的生产能力来确定。验证批是能够出售的∑验证方案,原辅料,成品标准,分析方法转移方案,模具图纸,稳定性方案,保留时间确认研究需客户确认∑包装形式,小盒,说明书,铝箔,PVC/PVDC要与MA上所批准的一致∑压片模具(需一个月),包装模具(需两个月)需客户确认,是整个产品转移的长板∑需要提供3-6月加速稳定性及长期稳定性数据,但不属于申报材料的一部分技术转移资料∑技术转移文件审核清单°DocneededforPresentation100627-Technical-Doca-Requirements-Lee.doc5
技术转移资料∑MA(市场经营权)°DocneededforPresentationBBBTabs2.5mg-MA.pdf∑批生产记录(BMR),产品验证方案(MVP)(需要与当前的MA一致)∑批包装记录(BPR)∑原料,辅料,成品标准∑原料,辅料,成品分析检测方法∑实样∑压片模具的图纸,胶囊填充模具图纸,包装模具图纸技术可行性评估∑技术部职责-TD¾产品处方确认¾原辅物料技术标准确认(DMF,COS-CEP)¾生产工艺确认¾生产批量(600kg,2000L)∑生产部-PD¾生产设备(混合机,制粒机,压片机,胶囊填充机,包衣机,包装机)¾生产环境(温度,湿度,避光,PPE)¾包装形式,包装材质(盲文小盒)∑质量保证部-QA¾法律法规(药品,食品添加剂,普药,一级/二级/三级/四级类,毒性-LD50,OEL,高活性类药,激素类药,消炎药)∑质量控制部-QC¾分析方法确认,分析仪器,设备(HPLC,GC,AA,Titrator,IC)¾试剂,标准品,色谱柱确认6
技术部职责-TD∑产品处方确认∑原辅物料技术标准确认∑生产工艺确认∑生产批量∑物料需求计划∑小试方案,记录∑中试方案,记录∑批生产记录(BMR)∑工艺验证方案(MVP)∑清洁验证方案(CVP)∑存放时间研究(HTS)质量控制部-QC∑试剂,标准品,色谱柱确认∑原料药,辅料,中间体,成品标准∑原料药,辅料,中间体,成品分析方法∑原料药,中间体,成品分析方法转移方案∑原料药,中间体,成品分析方法转移∑稳定性草案及稳定性研究∑原料药,辅料,包材,中间体,成品发行∑清洁验证分析方法研发,验证及样品检测7
生产部-PD∑冲钉图纸确认,采购(60天)∑包装模具确认,采购(60天)∑批包装记录编写∑内包装材质,标准确认∑外包装材料标准制定及外包装确认∑设备到位,验证情况质量保证部-QA∑原辅物料,包材供应商调查¾原料药供应商:现场审计¾辅料/包材供应商:发调查问卷或现场审计∑内包材标准制定小盒说明书泡罩标签(瓶签,箱签,托盘签)Blister铝箔-PVC(200,250mm)铝箔-PVDC(45,60,90,100,120gsm)瓶大小,材质瓶盖大小,材质瓶子Bottle瓶签干燥剂8
原辅料,包材原料API辅料Excipients包材(铝塑板)PackagingMaterials(Blister)小盒Carton铝箔AluminumPVC/PVDCPVC/PVDC标签(包括箱签,托盘签)Labels说明书Leaflet中包膜PlasticFoil箱Shipperbox托盘Pallet包材(瓶装)PackagingMaterials(Bottle)瓶Bottles说明书Leaflet标签(瓶签,箱签,托盘签)Labels干燥剂Desiccant中包膜PlasticFoil箱ShipperBox托盘Pallet调查问卷∑DocneededforPresentation调查问卷.pdf∑DocneededforPresentationTSE问卷模板.pdf∑DocneededforPresentation原料需要文件.pdf9
新增加、或新修订包装的主要流转程序PDF开放式格式,并标示有尺寸、颜色标号,是a)包装设计电子稿作为印刷的文字依据,客户向工厂项目启动即可提供。最迟提供最好是与拟生产包装一致;如果以前没有,则用在订单下达前1个月b)包装实样前一个版本或类似包装代替。是作为材质、式样参考1)确认电子稿格式是否可用于印刷;如版本一般在收到电子版后1周内;文件格式能兼容不能用,则需客户重新提供。紧急时2天内。工厂转换2)必要时转换,并按机器形式作必要排版对修改部分的确认,客户(如铝箔);修改部分的沟通,客户确认宜在1周内答复。并增加工厂内部版本号(如果客户允许的话)说明书、铝箔、大箱等一般用文字稿打样确认,工厂将电子版(京新格式)发印刷厂,按包简单的小盒或改版修订部分内容的小盒或标签,装的复杂程度,选择文字稿打样(干法证明)也选择文字稿打样;一般在1-2周或实样打样(湿法证明)对于复杂的小盒或标签,如带盲文、多层式,则工厂组织打使用实样打样。样A)文字稿打样工厂按客户文字稿核对一般1周工厂按客户文字稿,并结合实样的材质、式样核B)实样打样一般2周对A)确认京新发送的印刷前电子稿:打印出适用于干法证明的样稿,如明书、铝箔、大箱、客户在收到文件后,宜在1并签字,寄回或彩色扫描件发回京新简单的小盒或改版修订部分内容的小盒或标签周内答复。客户确认B)确认复杂的实样:按A步签名确认电子稿,在收到样品后,客户宜在1适用于复杂的小盒或标签或在实样上签字周内答复。正式印刷京新在收到客户确认批准的文字稿或实样后,安排印刷。如果在此过程中有修改,再回到起始步骤。质量源于设计开发设计生产产品质量产品的测试只用于确认产品的质量10
质量源于设计制定目标产品的质量和特性设计产品配方及生产工艺确认关键的原辅料特性,关键的工艺参数控制原辅料质量标准,工艺流程持续生产高质量的产品原料药影响药物性能和质量∑原料药物理化学性质¾物理性质描述¾pKa¾多晶体(x-射线,差热扫描和文献)¾水溶性(作为pH函数)¾粒径,粒径分布,松密度,紧密度¾吸湿性∑机械性能11
原料药∑原料药中杂质:合成过程中产生的,潜在的,实际存在的杂质¾降解杂质¾工艺杂质(稳定性实验/强降解实验中杂质含量不增加)ß标准设定:ICH,参比制剂,药典原料药∑原料药必须符合药典的要求(DMF,COS-CEP)∑确定控制原料药的标准是否应包括一些特定的检测项,例如旋光度、含水量、杂质、溶剂残留、固态特性(例如,多晶型,无定形,溶解性,粒度和密度等)∑了解原料药的稳定性,复检期,有效期和储存条件12
辅料∑辅料的技术规范是什么?¾如果物料有药典的标准(USP/NF、BP/EP,等),则技术规范应基于药典专论¾对起关键作用或特定分级的辅料可能需要附加技术规范以控制,如:辅料级别(Lastosemonohydrate70M,11SD)∑了解每种辅料的作用:粘合剂,润滑剂,分散剂,崩解剂∑辅料是否超出(例如FDAIIG)该给药途径药物非活性成分指南限度?¾考虑药品给药途径¾按推荐的每日最大给药剂量估算辅料用量是否超出IIG成品∑质量:外观,含量,溶出度,均匀度,杂质∑鉴别配方中影响药物性能,质量和稳定性的关键成分:辅料及其级别的选择∑明确和控制关键的生产步骤∑识别,检测和控制关键的工艺参数:中控参数(外观,硬度,脆碎度,片重,崩解,含水量),可接收限度以及设定的理由(硬度范围,极端条件下的溶解度和脆碎度)13
技术转移批量小试中试批验证批PilotValidationTrialBatchBatchFull1/10ofManufacturing1/10-1/5ofValidationSize(30%-65%PilotBBatchBatchofBlenderVolume)∑申报策略:3x中试批;2x中试批+1x验证批;2-3x验证批成品∑生产工艺与药物质量的关系原料包衣胶囊纯度高含量高溶出度高高高稳定性高∑需详细描述生产工艺的重要变更:批量,设备和工艺参数14
批生产记录BMR∑DocneededforPresentationBMRYYYY.docx批包装记录BPR∑DocneededforPresentationBMRYYYY.docx15
分析方法∑原料药(API)¾含量(Assay)¾降解产物(RelatedCompounds)¾溶剂残留(ResidualSolvent)∑成品¾含量(Assay)¾降解产物(DegradationProducts)¾溶出度(Dissolution)¾溶剂残留(ResidualSolvent)¾微生物(MicroAnalysis)方法方法验证?分析方法转移?分析方法转移方案∑原料药¾药典方法:不用转移(needDMF,COS-certificateofSuitability,CEPnumber)¾非药典方法(厂家):需要转移∑成品¾药典方法:需要转移(一般)¾非药典方法(厂家):需要转移16
分析方法转移方案∑含量(原料和成品)、溶出度(HPLC方法)¾系统适应性¾系统精密度¾线性¾方法精密度DocneededforPresentationmethodtransferwi_tt004-Assay.pdfDocneededforPresentationmethodtransferwi_tt010-Disso-HPLC.pdf分析方法转移方案∑降解产物(原料和成品)¾系统适应性(SS)¾系统精密度(SP)¾定量检测线(QL)¾样品分析结果(包括谱图:SS,std,solvent,placebo,sample),样品谱图相似∑DocneededforPresentationmethodtransferwi_tt006-RC.pdf17
分析方法转移方案∑残留溶剂(原料和成品)¾系统适应性(SS)¾系统精密度(SP)¾定量检测线(QL)¾样品分析结果(包括谱图:SS,std,solvent,placebo,sample),样品谱图相似¾加入标准的样品分析:回收率∑DocneededforPresentationmethodtransferwi_tt008-RS.pdf分析方法转移方案∑滴定分析方法转移¾DocneededforPresentationDocneededforPresentationmethodtransfermethodtransferwitt005wi_tt005-titration.pdf∑薄层分析方法转移¾DocneededforPresentationmethodtransferwi_tt007-RC-TLC.pdf∑粒径分析方法转移¾DocneededforPresentationmethodtransferwi_tt011-PS.pdf18
药典分析方法确认∑DocneededforPresentationmethodtransfermethodverification.pdf方法需要确认的参数含量(原料药)系统精确度,耐用性系统精确度,方法精确度,准确度,选择性,含量(成品)耐用性系统精确度,方法精确度,准确度,定量检降解产物(原料药,成品)出限,选择性,线性,耐用性,范围限度检测(原料药,成品)系统精确度,检出限,选择性,耐用性一级标准品∑DocneededforPresentationcoq_ps002.pdf19
二级工作标准品∑参比标样¾USP,EP(药典当前的批次);BP(开瓶后3个月之内)∑原料药:¾符合供应商所设标准,符合厂家标准,纯度高,合适的原料有效期,足够的量∑分析方法¾用于原料稳定性的原料含量HPLC方法¾若没有,分析成品含量的HPLC方法∑表达形式¾AsIs¾P(纯度)=A(含量)x100/(100-D(水分))∑再标定期限¾一年一次(有稳定性数据支持,不能超过供应商提供的有效期)¾可以多于一年(根据质检报告中失效期,但质检报告有效期不能作为再次标定的期限)申报所需材料1批生产记录(空白)BatchManufacturingRecord(Blank)2批生产记录BatchManufacturingRecord-BMR3批包装记录(空白)BatchPackingRecord-BPR(Blank)4批包装记录BatchPackingRecord-BPR5分析方法Analyticalmethods6分析方法转移方案与报告MethodTransferProtocolandReport7工艺验证方案与报告ProcessValidationProtocalandReport8厂家原辅料标准Specification9供应商及厂家检验报告CofAofSupplierandYiling10稳定性研究草案StabilityStudyProtocol11清洁验证分析方法AnalyticalMethodforTestingtheResiduals12清洁验证方案CleaningValidationProtocol20
申报所需材料∑技术转移申报所需提交材料清单°DocneededforPresentationCheck-list1.docx°DocneededforPresentationCheck-list2.docx°DocneededforPresentationCheck-list3.docxYilingPharmaceuticals___________________设备清洁验证∑充分证明清洗与产品接触的生产设备所用的清洁方法及操作规程能有效地,连续地去除上批产品/清洁剂残留,达到预先确定的限度(对人体健康无危害的允许限度内)。保证对下批产品无影响(FDA缺陷:交叉污染,原辅料中发现黑点/黑颗粒/外来物,设备上-连接管残留粉末)。¾化学物质残留°上批产品的原料°清洁剂¾微生物残留21
设备清洁验证∑清洁验证方案:对同一产品要进行至少3批清洁验证。¾选择产品(最难清洁的物质-theworst-caseprodtduct))¾选择设备(最难清洁的部位、最难取样的部位-theworst-casepiece)¾可接受标准(产品A能进入到产品B而不导致风险的最大量)-活性成分,清洁剂¾取样方式¾清洁验证分析方法(API残留-HPLC方法,有机物残留-TOC方法)设备清洁验证∑选择设备(确认要清洗的设备和部件)¾确定两个产品共用接触部分,设备部件¾选择接触表面积最大的设备和部件¾考虑所选设备中最不易清洗的部件(Theworst-casepiece)¾确认设备中最难取样的部位¾DocneededforPresentationDocneededforPresentation清洁验证主计划A01Annexure1EquipmentRiskAnalysisTable-short.doc22
设备清洁验证∑选择产品:对物质进行分组¾对同一产品,选择最大规格(如阿替洛尔25、50、100mg,选择100mg)¾对不同产品,考虑三个标准°最难清洁(如有颜色的产品)(清洁难易度,如颜料被认为最不易清洗的)°水中溶解性最小(溶解度)°活性/毒性最大(活性/毒性)¾三个数字相乘,获得最大值的产品就是要验证的产品设备清洁验证∑对每个产品的清洁难易程度打分,1~4分,颜料被认为最不易清洗的。1分:容易清洁,2分:相对容易清洁,3分:难以清洁,4分:很难清洁品名ABCDEF清洁难易程度容易相对容易很难很难容易容易打分12441123
设备清洁验证∑水中溶解度¾1分:易溶,2分:溶解,3分:微溶,4分:不溶品名ABCDEF水中溶解度易溶几乎不溶几乎不溶不溶微溶水溶打分144432设备清洁验证按照毒性/活性对产品分类(Max.AllawableCarry-Over)MACO=NOEL×MBS/SF×TDDnextNOEL=LD5(g/kg)×70(kgaperson)/2000∑MACO:所研究药物的最大允许负载量∑NOEL:最大安全量∑LD50:动物的半数致死量,单位为mg/kg∑70kg:一般成人的体重以70kg计算∑2000:经验常数∑TDDnext:下一个产品的最大日剂量(g)∑MBS:下一个产品的最小批量(mg)∑SF:Safetyfactor安全系数(200)24
设备清洁验证按照毒性/活性对产品分类品名ABCDEFLD50mg/kg160152033673710400010000TDD(mg)90090010000906030MBS(kg)120577.8119282235161.7MACO121.31152.32552.52812.63032.47581打分632221毒性顺序(MACO)1)>5000,2)2000-5000,3)2000-1000,4)1000-500,5)500-300,6)300-100,7)<100设备清洁验证∑选择产品品名ABCDEF清洁难易程度124411水中溶解度144432MACO632221三个数字相乘624323262¾产品C和产品D的分数相同,选择产品C和D为要验证的产品。25
设备清洁验证-可接受标准0.001/0.1%(ug/100cm2)A产品最小治疗剂量(mg)B产品批量(粒)100cm20.001XXXX回收率(%)X1000uggg/mgB产品最大日剂量(粒/天)A,B产品共用设备面积(cm2)棉签10ppm(ug/100cm2)10mgA产品B产品批量(kg)100cm2XXX回收率(%)X1000ug/mg1kgB产品A,B产品共用设备面积(cm2)棉签LD50((g/ug/100cm2))–常用于清洁剂的残留A产品LD50(mg/kg)儿童体重(10kg)B产品批量(粒)100cm2XXX回收率(%)X1000ug/mgB产品最大日剂量(粒/天)安全系数(1000)A,B产品共用设备面积(cm2)棉签设备清洁验证-可接受标准∑清洗后设备没有肉眼可见残留物∑活性成分接受限度°剂量标准:产品日最大剂量中,上次产品残留量不得超过其剂量的0.001%。当药物浓度为正常处方量的0.1%时,可认为无活性,那么验证活动是有效的。°10PPM标准:在其他产品中的残留量不超过10PPM,依据为食品适用法规∑口服固体制剂微生物限度°总需氧菌(Totalaerobicmicrobialcount)-NMT1000cfu/g°总酵母菌和霉菌(TotalcombinedYeastandmoldcount)-NMT100cfu/g°大肠埃细菌(E.coli)-未检出∑美国药典规定不得检出的微生物°金黄色葡萄球菌(S.aureus)-未检出°沙门氏菌(Salmonellaspecies)-未检出26
设备清洁验证-采样∑设备不同部件,不同位置(包括难清洁的位置)采样顺序测试采样面积可接受标准25cfu–接触面1微生物25100cfu–非接触面积2活性成分100*计算值3清洁剂100*计算值*可调节,最少面积为:10cm2设备清洁验证-采样∑根据清洁方案,采样前,¾目视检测°设备内表面无可见残留物痕迹°白布擦拭无污迹¾不合格,记录并重新清洗27
设备清洁验证-采样∑面积:10x10cm(最小采样面积:10cm2,长方形)∑棉签:灭菌的,预先处理过的,2-3棉签擦拭法取样∑取样溶剂(用于润湿棉签):纯化水,取样溶剂(例如:乙醇,75%乙醇),可以与萃取溶剂不同∑萃取溶剂∑取样顺序:1)微生物限度取样(纯化水),2)化学取样(取样溶剂),3)清洗剂取样(纯化水)∑容器:10-15mL塑料和玻璃试管(带盖)设备清洁验证-采样采样方式:2-3药用棉纱,棉签,textwipes对于不易擦拭的设备,如刷子采用淋洗的方法28
设备清洁验证-分析方法∑建议HPLC和HPLC-MS方法(检测线低)∑标准品浓度:可接受标准ug/溶剂体积方法验证参数试验标准溶剂(水,擦洗剂,萃取剂),棉签,选择性标准品,不同材质的表面,清洁剂,辅无干扰料过滤试验比较过滤前和过滤后标准品偏差%:NMT2%1)MT90%,不需要加校正因子1.棉签回收率,2)设备表面回收率回收率2)70%-90%,需要加校正因子(50%,100%,150%精确度)3)NLT70%:1)MT90%,不需要加校正因子1.标样溶液稳定性,2)样品在棉签上稳定性2)LT90%,需要加校正因子的稳定性(0,1,3天)1.系统精密度,2.分析方法精密度%RSD:NMT10%精密度(棉签回收率-6样品)设备清洁验证-分析方法∑继续方法验证参数试验标准耐用性1.流动相组成1.+/-5%2.柱子温度2.+/-2C3.流速3.+/-10%4.萃取时间4.30s,60sand90s线性10%-180%标准品浓度R2=0.997定量检测线10%标准品浓度%RSD:NMT10%检测线S/N3:129
设备清洁验证-分析方法∑回收率(综合回收率一般不低于50%)∑操作程序:萃取溶剂:乙醇(API)和USP/BP纯化水(清洁试剂)∑两个棉签∑颜料被认为最不易清洗的。设备清洁验证∑清洁验证方案举例°DocneededforPresentation清洁验证方案2010.05.14.doc30
准备GMP文件的现场检查∑核实与生产环节紧密相关的所有文件上所记载的原始数据的真实性和准确性∑保证使用的分析方法,设施与控制系统,生产,工艺流程,包装等符合药品生产质量管理规范(GMP)的标准∑制作文件,修订文件,准备GMP检查文件准备GMP文件的现场检查∑要求:遵循SOP,记录生产过程中具体操作,观察和原始数据¾文件永久性:黑色墨水圆珠笔,不允许用铅笔,热敏纸数据要拷贝¾文件易读性:如发现错误,用单线划掉,补上正确信息,签名和日期,最好不要涂改标样和样品的重量¾文件及时性:记录在QA批准的WS和实验记录本,杜绝从草稿纸转抄到实验记录本。原始数据:重量,缓冲溶液,标样,样品的制备,仪器型号,有效期,色谱柱,分析条件,等。信息:计算结果和结论(OOS)¾文件完整性:根据记录,另一个人可以能重复操作。附件,空间参考文献的处理。¾文件的时间顺序性:同时进行几个项目,注明日期,连续性31
准备GMP文件的现场检查∑文件的真实性¾严格控制生产和实验记录本¾原始数据的真实性和准确性•仪器校正•天平连打印机•如实记录所观察的数据•原始数据不能被删除•审核员审核原始数据和原始记录准备GMP文件的现场检查∑DocneededforPresentationcGMP审计准备.docx32
准备GMP文件的现场检查∑BMR¾生产日期¾主要设备和生产线的验证¾原辅料和中间材料标准¾原辅料重量和检测结果¾中间产品及检测结果¾包装和标签的检测¾实际产率和理论产率¾标签全部的控制记录,包括样品和复印件¾包装形式¾采样记录¾执行,监督或检查操作过程中每一个重要环节的人员签名确定¾偏差调查报告准备GMP文件的现场检查∑化学,生产和控制¾批生产和批包装记录¾原辅料及成品的标准和检测方法¾原辅料及成品所用包材的名称和供应商厂址¾原辅料和成品分析测试结果¾委托生产,加工,包装和测试单位的名称和地址,并指出合同单位的具体操作部门¾生产记录模板,包括标准,所用设备,具体生产工艺详细过程和控制33
准备GMP文件的现场检查∑验证报告,包括验证方案(范围,测试参数,可接受标准),数据和报告¾生产设备清洗的验证¾生产工艺验证¾分析方法验证准备GMP文件的现场检查∑变更:对文件的修改过程从发起人,审查,评估到批准都必须以文字的形式记录下来∑变更总结:包括在生产过程中所有文件的修改∑变更报告:每一个变更对生产过程的影响34
准备GMP文件的现场检查∑偏差记录:没有按照已建立的质量操作标准而采取的任何行动,包括SOP,批生产记录,批包装记录,包材标准,原料及成品标准,分析方法,仪器检测和校准规程,设备保养时间。∑建立一套管理偏差记录档案的系统准备GMP文件的现场检查∑安装合格和操作合格文件证书:设备和仪器¾例如:混合,包装,压片,装胶囊,HPLC,UV,GC,溶出仪等∑产品目录:正在生产的产品目录用于判断同一车间生产的产品是否有存在交叉污染的可能。∑场地规划图¾地面规划:厂房结构,无菌环境的工作人员和设备与非无菌环境的工作人员和设备完全分开。¾工厂和地面:车间厂房相互之间的连接和流程。35
准备GMP文件的现场检查∑公用设施图¾保湿,通风好空调系统:没有因空气流通产生交叉污染的可能,标明生产车间,公共走廊及空气连锁之间的空气压差¾水系统:水系统的建立,分布和取样测试的分布点。保证运水管道没有死角,防止污垢积累和细菌的繁殖。准备GMP文件的现场检查∑产品稳定性:稳定性方案(条件,分析方法)和稳定性数据的准确性¾测试:含量,降解杂质,溶出度,水分含量¾条件:25C/60%RH(正常存储);40C/75%RH(加速存储),OSD包装容器大小(75cc,120cc,1000cc),光稳定性研究¾时间点:1,2和3个月(加速存储);3,6,9,12,18,24个月(正常存储)36
准备GMP文件的现场检查∑SOP:生产,加工,包装,测试全过程,及其SOP的管理(分类按索引存档,快速提供)∑培训记录:建立个人培训记录¾相关本职工作的SOP¾有关业务的培训课程,证书ThanksforyourattentionAnyquestions?37'
您可能关注的文档
- 中国生物制药行业发展规划及投资前景咨询报告2016-2021年
- 2017-2022年中国制药行业发展前景调查和投融资战略研究报告
- 台湾制药行业发展的启示
- 日本制药行业发展历程总结和思考
- 生物制药行业发展状态及方向
- 制药行业发展趋势(博世)
- 某年中国生物制药行业发展现状及前景预估分析报告
- xx年中国生物制药行业发展现状及前景预估分析报告
- 中国生物制药行业发展研究报告
- 2010年美国和欧洲生物制药行业发展概况(新批药物和临床实验潜力极大的在研药物)
- xxxx-xxxx年中国生物制药行业发展预测分析
- 2009-2012年中国生物制药行业发展预测分析报
- 我国制药行业发展现况及策略探讨分析
- 研究反渗透膜的应用在制药行业发展.doc
- 甲磺酸帕珠沙星冻干粉针剂市场调研报告
- 粉针剂市场最新调研报告2017年.docx
- 粉针剂市场最新调研报告
- 2016-2022年中国口服液市场前景研究与投资前景分析报告.doc