- 1.75 MB
- 2022-04-29 14:14:56 发布
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
'《绪论》部分重点习题及参考答案1.如何认识现代环境问题的发展过程?环境问题不止限于环境污染,人们对现代环境问题的认识有个由浅入深,逐渐完善的发展过程。a、在20世纪60年代人们把环境问题只当成一个污染问题,认为环境污染主要指城市和工农业发展带来的对大气、水质、土壤、固体废弃物和噪声污染。对土地沙化、热带森林破环和野生动物某些品种的濒危灭绝等并未从战略上重视,明显没有把环境污染与自然生态、社会因素联系起来。b、1972年发表的《人类环境宣言》中明确指出环境问题不仅表现在水、气、土壤等的污染已达到危险程度,而且表现在对生态的破坏和资源的枯竭;也宣告一部分环境问题源于贫穷,提出了发展中国家要在发展中解决环境问题。这是联合国组织首次把环境问题与社会因素联系起来。然而,它并未从战略高度指明防治环境问题的根本途径,没明确解决环境问题的责任,没强调需要全球的共同行动。c、20世纪80年代人们对环境的认识有新的突破性发展,这一时期逐步形成并提出了持续发展战略,指明了解决环境问题的根本途径。d、进入20世纪90年代,人们巩固和发展了持续发展思想,形成当代主导的环境意识。通过了《里约环境与发展宣言》、《21世纪议程》等重要文件。它促使环境保护和经济社会协调发展,以实现人类的持续发展作为全球的行动纲领。这是本世纪人类社会的又一重大转折点,树立了人类环境与发展关系史上新的里程碑。2.怎样了解人类活动对地球环境系统的影响地球环境系统即为生物圈,生物圈有五大圈层组成:大气圈水圈生物圈土壤圈岩石圈这五大圈层受到人类影响也就影响了整个地球环境系统例如:大气圈,人类的工业化,是的矿物质燃料使得co2so2等气体大量进入大气中是的大气吸收的地面的长波辐射增多,形成保温层这就是我们说的温室效应生物圈:人类的砍伐,屠杀野生动物,造成生态系统的破坏,食物链的断裂或减少,是的生态系统的物质循环,能量流动受到影响造成灾害各种生态系统的恢复力减弱抗破坏力减弱土壤圈:树木的砍伐造成水土流失,人们盲目施肥造成土壤污染水圈:水的污染就不用说了岩石圈:人类活动的原因引发酸雨,溶洞腐蚀,砍伐造成风沙肆虐风化现象加剧而且五大圈层相辅相成,一个受到影响会引发其他的影响,进而造成自然灾害,造成生命财产损失,人类的活动最终的苦果还要人类自己承受1
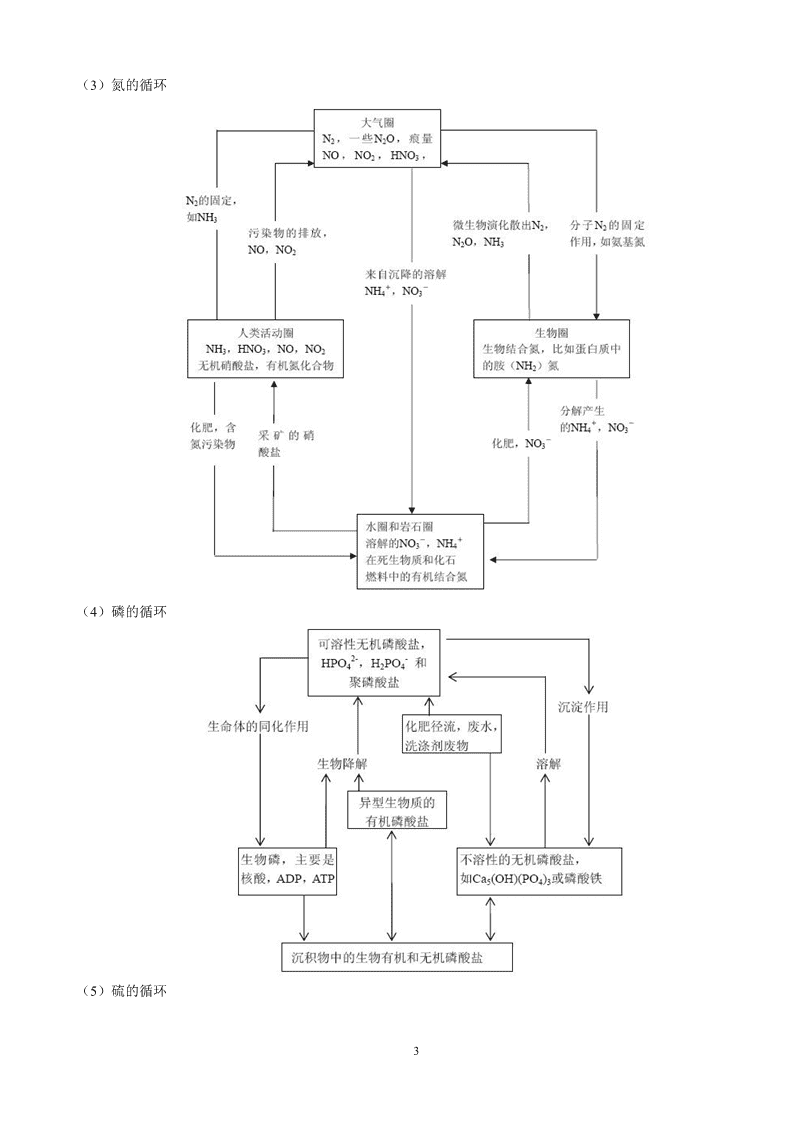
2.你对于氧、碳、氮、磷、硫几种典型营养性元素循环的重要意义有何体会?(1)氧的循环:(2)碳的循环:2
(3)氮的循环(4)磷的循环(5)硫的循环3
(6)体会:氧、碳、氮、磷和硫等营养元素的生物地球化学循环是地球系统的主要构成部分,它涉及地层环境中物质的交换、迁移和转化过程,是地球运动和生命过程的主要营力。3.根据环境化学的任务、内容和特点以及其发展动向,你认为怎样才能学好环境化学这门课程?(1)环境化学的任务、内容、特点:环境化学是在化学科学的传统理论和方法基础上发展起来的,以化学物质在环境中出现而引起的环境问题为研究对象,以解决环境问题为目标的一门新兴学科。环境化学是一门研究有害化学物质在环境介质中的存在、化学特性、行为和效应及其控制的化学原理和方法的科学。它既是环境科学的核心组成部分,也是化学科学的一个新的重要分支。(2)环境化学的发展动向:国际上较为重视元素(尤其是碳、氮、硫、磷)的生物地球化学循环及其相互耦合的研究;重视化学品安全评价;重视臭氧层破坏、气候变暖等全球变化问题。我国优先考虑的环境问题中与环境化学密切相关的是:以有机物污染为主的水质污染;以大气颗粒物和二氧化硫为主的城市空气污染;工业有毒有4
害废弃物和城市垃圾对大气、水和土地的污染等。(3)我对学好这门课的观点:环境化学包含大气、水体和土壤环境化学多个分支学科,研究有害化学物质在大气、水体和土壤环境中的来源、存在、化学特性、行为和效应及其控制的化学原理和方法。这就决定了环境化学研究中需要运用现场研究、实验室研究、实验模拟系统研究和计算机模拟研究相结合的系统研究方法,主要以化学方法为主,还要配以物理、生物、地学、气象学等其他学科的方法。因此,要求研究人员具有较广泛的各相关学科的理论知识和实验动手能力。我们在日常学习中应当以开阔的视野,除了环境化学之外,广泛涉猎各相关学科,并注重培养自己的实验操作,如此才可能学好这门课。4.举例简述污染物在环境各圈的迁移转化过程。以汞为例,说明其在环境各圈层的迁移转化过程,见下图。汞在环境中的存在形态有金属汞、无机汞化合物和有机汞化合物三种。在好氧或厌氧条件下,水体底质中某些微生物能使二价无机汞盐转变为甲基汞和二甲基汞。甲基汞脂溶性大,化学性质稳定,容易被鱼类等生物吸收,难以代谢消除,能在食物链中逐级放大。甲基汞可进一步转化为二甲基汞。二甲基汞难溶于水,有挥发性,易散逸到大气中,容易被光解为甲烷、乙烷和汞,故大气中二甲基汞存在量很少。在弱酸性水体(pH4~5)中,二甲基汞也可转化为一甲基汞。CH4C2H6Hg空气(CH3)2Hg鱼水+CH3Hg+细菌HgCH3Hg(CH3)2Hg细菌细菌Hg2+Hg2+沉积物2+Hg细菌图1-1汞的迁移转化循环《大气环境化学》重点习题及参考答案5
3.大气中有哪些重要污染物?说明其主要来源和消除途径。环境中的大气污染物种类很多,若按物理状态可分为气态污染物和颗粒物两大类;若按形成过程则可分为一6
次污染物和二次污染物。按照化学组成还可以分为含硫化合物、含氮化合物、含碳化合物和含卤素化合物。主要按照化学组成讨论大气中的气态污染物主要来源和消除途径如下:(1)含硫化合物大气中的含硫化合物主要包括:氧硫化碳(COS)、二硫化碳(CS2)、二甲基硫(CH3)2S、硫化氢(H2S)、二氧化硫(SO2)、三氧化硫(SO3)、硫酸(H2SO4)、亚硫酸盐(MSO3)和硫酸盐(MSO4)等。大气中的SO2(就大城市及其周围地区来说)主要来源于含硫燃料的燃烧。大气中的SO2-2约有50%会转化形成H2SO4或SO4,另外50%可以通过干、湿沉降从大气中消除。H2S主要来自动植物机体的腐烂,即主要由植物机体中的硫酸盐经微生物的厌氧活动还原产生。大气中H2S主要的去除反应为:HO+H2S→H2O+SH。(2)含氮化合物大气中存在的含量比较高的氮的氧化物主要包括氧化亚氮(N2O)、一氧化氮(NO)和二氧化氮(NO2)。主要讨论一氧化氮(NO)和二氧化氮(NO2),用通式NOx表示。NO和NO2是大气中主要的含氮污染物,它们的人为来源主要是燃料的燃烧。大气中的NOx最终将转化为硝酸和硝酸盐微粒经湿沉降和干沉降从大气中去除。其中湿沉降是最主要的消除方式。(3)含碳化合物大气中含碳化合物主要包括:一氧化碳(CO)、二氧化碳(CO2)以及有机的碳氢化合物(HC)和含氧烃类,如醛、酮、酸等。CO的天然来源主要包括甲烷的转化、海水中CO的挥发、植物的排放以及森林火灾和农业废弃物焚烧,其中以甲烷的转化最为重要。CO的人为来源主要是在燃料不完全燃烧时产生的。大气中的CO可由以下两种途径去除:土壤吸收(土壤中生活的细菌能将CO代谢为CO2和CH4);与HO自由基反应被氧化为CO2。CO2的人为来源主要是来自于矿物燃料的燃烧过程。天然来源主要包括海洋脱气、甲烷转化、动植物呼吸和腐败作用以及燃烧作用等。甲烷既可以由天然源产生,也可以由人为源产生。除了燃烧过程和原油以及天然气的泄漏之外,产生甲烷的机制都是厌氧细菌的发酵过程。反刍动物以及蚂蚁等的呼吸过程也可产生甲烷。甲烷在大气中主要是通过与HO自由基反应被消除:CH4+HO→CH3+H2O。(4)含卤素化合物大气中的含卤素化合物主要是指有机的卤代烃和无机的氯化物和氟化物。大气中常见的卤代烃以甲烷的衍生物,如甲基氯(CH3Cl)、甲基溴(CH3Br)和甲基碘(CH3I)。它们主要由天然过程产生,主要来自于海洋。CH3Cl和CH3Br在对流层大气中,可以和HO自由基反应。而CH3I在对流层大气中,主要是在太阳光作用下发生光解,产生原子碘(I)。许多卤代烃是重要的化学溶剂,也是有机合成工业的重要原料和中间体,如三氯甲烷(CHCl3)、三氯乙烷(CH3CCl3)、四氯化碳(CCl4)和氯乙烯(C2H3Cl)等均可通过生产和使用过程挥发进入大气,成为大气中常见的污染物。它们主要是来自于人为源。在对流层中,三氯甲烷和氯乙烯等可通过与HO自由基反应,转化为HCl,然后经降水而被去除。氟氯烃类中较受关注的是一氟三氯甲烷(CFC-11或F-11)和二氟二氯甲烷(CFC-12或F-12)。它们可以用做致冷剂、气溶胶喷雾剂、电子工业的溶剂、制造塑料的泡沫发生剂和消防灭火剂等。大气中的氟氯烃类7
主要是通过它们的生产和使用过程进入大气的。由人类活动排放到对流层大气中的氟氯烃类化合物,不易在对流层被去除,它们在对流层的停留时间较长,最可能的消除途径就是扩散进入平流层。4.影响大气中污染物迁移的主要因素是什么?主要有:(1)空气的机械运动如风和大气湍流的影响;(2)天气和地理地势的影响;(3)污染源本身的特性。6.太阳发射光谱和地面测得的太阳光谱有何不同?为什么?太阳辐射的光谱包括红外线、可见光和紫外线等,其经过大气层被削弱了约一半,其中紫外线和红外线被极大的削弱所剩无几,但可见光却几乎都能到达地表,其比重也由47%上升到92%。即光谱分布就不同了。7.大气中有哪些重要的自由基?其来源如何?大气中存在的重要自由基有HO、HO2、R(烷基)、RO(烷氧基)和RO2(过氧烷基)等。它们的来源如下:(1)HO来源对于清洁大气而言,O3的光离解是大气中HO的重要来源:OhvOO32OHO2HO2对于污染大气,如有HNO2和H2O2存在,它们的光离解也可产生HO:HNOhvHONO2HOhv2HO22其中HNO2的光离解是大气中HO的重要来源。(2)HO2的来源大气中HO2主要来源于醛的光解,尤其是甲醛的光解:HCOhvHHCO2HOMHOM22HCOOHOCO22任何光解过程只要有H或HCO自由基生成,它们都可与空气中的O2结合而导致生成HO2。亚硝酸酯和8
H2O2的光解也可导致生成HO2:CHONOhvCHONO33CHOOHOHCO3222HOhv2HO22HOHOHOHO2222如体系中有CO存在:HOCOCOH2HOHO22(3)R的来源大气中存在量最多的烷基是甲基,它的主要来源是乙醛和丙酮的光解:CHCHOhvCHHCO33CHCOCHhvCHCHCO3333这两个反应除生成CH3外,还生成两个羰基自由基HCO和CH3CO。O和HO与烃类发生H摘除反应时也可生成烷基自由基:RHORHORHHORHO2(4)RO的来源大气中甲氧基主要来源于甲基亚硝酸酯和甲基硝酸酯的光解:CHONOhvCHONO33CHONOhvCHONO3232(5)RO2的来源大气中的过氧烷基都是由烷基与空气中的O2结合而形成的:RORO229
9.叙述大气中NO转化为NO2的各种途径。①NO+O3NO2+O2②HO+RHR+H2OR+O2RO2NO+RO2NO2+ROR`CHO+HO2(R`比R少一个C原子)RO+O2NO+HO2NO2+HO10.大气中有哪些重要的碳氢化合物?它们可发生哪些重要的光化学反应?甲烷、石油烃、萜类和芳香烃等都是大气中重要的碳氢化合物。它们可参与许多光化学反应过程。(1)烷烃的反应:与HO、O发生H摘除反应,生成R氧化成RO2与NO反应RH+OH→R+H2ORH+O→R+HOR+O2→RO2RO2+NO→RO+NO2(2)烯烃的反应:与OH主要发生加成、脱氢或形成二元自由基加成:RCH=CH2+OH→RCH(OH)CH2RCH(OH)CH2+O2→RCH(OH)CH2O2RCH(OH)CH2O2+NO→RCH(OH)CH2O+NO2脱氢:RCH=CH2+HO→RCHCH2+H2O生成二元自由基:OR1R3R1OOR3O3+CCCCR2R4R2R4R1OOR3CO+CR2R4R1OOR3C+OCR2R4二元自由基能量很高,可进一步分解为两个自由基以及一些稳定产物。另外,它可氧化NO和SO2等:R1R2COO+NO→R1R2CO+NO210
R1R2COO+SO2→R1R2CO+SO3(3)环烃的氧化:以环己烷为例+HO+H2OOO+O2OOO+NO+NO2(4)芳香烃的氧化(a)单环芳烃:主要是与HO发生加成反应和氢原子摘除反应。CH3OHHCH3CH3CH3OHOH+HOH用H表示CH3OHH生成的自由基可与NO2反应,生成硝基甲苯:CH3CH3OHH+NO2+H2ONO2加成反应生成的自由基也可与O2作用,经氢原子摘除反应,生成HO2和甲酚:CH3CH3OHOHH+O2+HO211
生成过氧自由基:CH3OHHHOOCH3CH3H3COOOHOHOHH+O2H用H表示OOCH3OHHHOOCH3CH3OHOHH+NOH+NO2OOOCH3OHH+O2OHCHCCHCHO+CH3C(O)CHOO(b)多环芳烃:蒽的氧化可转变为相应的醌HhvO+O2OH它可转变为相应的醌:HOOOHO(5)醚、醇、酮、醛的反应它们在大气中的反应主要是与HO发生氢原子摘除反应:CH3OCH3+HO→CH3OCH2+H2OCH3CH2OH+HO→CH3CHOH+H2OCH3COCH3+HO→CH3COCH2+H2O12
CH3CHO+HO→CH3CO+H2O上述四种反应所生成的自由基在有O2存在下均可生成过氧自由基,与RO2有相类似的氧化作用。11.碳氢化合物参与的光化学反应对各种自由基的形成有什么贡献?OH+RH—H2O+RM+R+O2-RO2+MRO2+NO-RO+NO2RO2+O2-HO2+羰基化合物RH为碳氢化合物12.说明光化学烟雾现象,解释污染物与产物的日变化曲线,并说明光化学烟雾产物的性质与特征。(1)光化学烟雾现象:主要含有氮氧化物和碳氢化合物等一次性污染物的大气,在阳光照射下发生化学反应而产生二次污染物。这种由一次和二次污染物的混合物所形成的烟雾污染现象称为光化学烟雾。因最早(1940年)在美国洛杉矶首先出现,又称洛杉矶型烟雾。(2)性质与特征:烟雾蓝色;具有强氧化性,能使橡胶开裂;对眼睛、呼吸道等有强烈刺激,并引起头痛、呼吸道疾病恶化,严重可造成死亡;对植物叶子有害,能使大气能见度降低;刺激物浓度峰值出现在中午和午后;污染区域出现在污染源下风向几十到几百公里的范围内。(3)日变化曲线:白天生成夜晚消污失;染物浓度峰值出现在中午和午后;烃类和NO发生在早上交通高峰时节,此时NO2浓度很低;随太阳辐射增强,O3和NO2浓度逐渐增加,到中午已经较高。一般O3和NO2浓度峰值比NO浓度峰值晚出现4-5小时。推断:O3和NO2主要是二次污染物。傍晚虽交通繁忙,但日光较弱,不足以引起光化学反应。13.说明烃类在光化学烟雾形成过程中的重要作用。光化学烟雾形成过程是由多种自由基参与的一系列反应,NO2和醛的光解可引发O、H自由基的产生,而烃类RH的存在又是自由基转化和增殖为数量大,种类多的根本原因。烃类在光化学烟雾形成过程中占有很重要的地位。RH+O→R+HORH+HO→R+H2OH+O2→HO2R+O2→RO2RCO+O2→RC(O)OO其中R为烷基、RO2为过氧烷基,RCO为酰基、RC(O)OO[RC(O)O2]为过氧酰基。通过如上途径生成的HO2、RO2和RC(O)O2均可将NO氧化成NO2。13
14.何谓有机物的反应活性?如何将有机物按反应活性分类?(1)有机物的反应活性:有机物的反应活性是指反应难易程度。反应中有些中间体能增加反应活性。正催化剂能产生容易反应的中间体,改变反应历程,缩短反应时间。(2)分类:按有机物所含官能团分类:烷、烯、炔、醇、酮、苯、酚、醚、羧酸、糖等。15.简述大气中S02氧化的几种途径。(1)SO2气相氧化:SO2首先氧化成SO3,随后S03被水吸收成硫酸,形成酸雨或硫酸烟雾。硫酸与大气中的NH4+等阳离子结合生成硫酸盐气溶胶。①S02的直接光氧化;②SO2被自由基氧化。(2)SO2液相氧化:大气中存在少量水和颗粒物。SO2可溶于大气中液体水,也可被大气颗粒物吸附,并溶解在颗粒物表面所吸附的水中。于是SO2便可发生液相反应。①S02液相平衡;②O3对SO2氧化;③H2O2对SO2氧化;④金属离子对SO2液相氧化催化作用。17.说明酸雨形成的原因酸性降水是指通过降水,如雨、雪、雾、冰雹等将大气中的酸性物质迁移到地面的过程。最常见的就是酸雨。这种降水过程称为湿沉降。酸雨现象是大气化学过程和大气物理过程的综合效应。酸雨中含有多种无机酸和有机酸,其中绝大部分是硫酸和硝酸,多数情况下以硫酸为主。从污染源排放出来的SO2和NOx是形成酸雨的主要起始物,其形成过程为:SO2+[O]→SO3SO3+H2O→H2SO4SO2+H2O→H2SO3H2SO3+[O]→H2SO4NO+[O]→NO22NO2+H2O→HNO3+HNO2大气中的SO2和NOx经氧化后溶于水形成硫酸、硝酸和亚硝酸,这是造成降水pH降低的主要原因。除此之外,还有许多气态或固态物质进入大气对降水的pH也会有影响。大气颗粒物中Mn、Cu、Ν等是酸性气体氧化的催化剂。大气光化学反应生成的O2和HO2•等又是使SO2氧化的氧化剂。因此,降水的酸度是酸和碱平衡的结果。如降水中酸量大于碱量,就会形成酸雨。18.确定酸雨pH界限的依据是什么?pH为5.6作为判断酸雨的界限。依据以下过程得出:在未污染大气中,可溶于水且含量比较大的酸性气体是CO32,所以只把CO2作为影响天然降水pH的因素,根据CO2的全球大气浓度330ml/m与纯水的平衡:KHCO2(g)+H2OCO2+H2OK1+-CO2+H2OH+HCO314
-K2+2-HCOH+CO33+--2-+根据电中性原理:[H]=[OH]+[HCO3]+2[CO3],将用KH、K1、K2、[H]表达的式子代入,得:+3+[H]–(KW+KHK1pCO2)[H]–2KHK1K2pCO2=0在一定温度下,KW、KH、K1、K2、pCO2都有固定值,将这些已知数值带入上式,计算结果是pH=5.6。论述影响酸雨形成的因素答影响酸雨形成的因素主要有:(1)酸性污染物的排放及其转化条件。(2)(2)大气中NH3的含量及其对酸性物质的中和性。(3)(3)大气颗粒物的碱度及其缓冲能力。(4)(4)天气形势的影响20.什么是大气颗粒物的三模态?如何识别各种粒子模?Whitby等人依据大气颗粒物表面积与粒径分布的关系得到了三种不同类型的粒度模。按这个模型,可把大气颗粒物表示成三种模结构,即爱根(Aitken)核模(Dp<0.05μm)、积聚模(0.05μm2μm)。(1)爱根核模主要源于燃烧产生的一次颗粒物以及气体分子通过化学反应均相成核而生成的二次颗粒物。由于它们的粒径小、数量多、表面积大而很不稳定,易于相互碰撞结成大粒子而转入积聚模。也可在大气湍流扩散过程中很快被其他物质或地面吸收而去除。(2)积聚模主要由核模凝聚或通过热蒸汽冷凝再凝聚长大。这些粒子多为二次污染物,其中硫酸盐占80%以上。它们在大气中不易由扩散或碰撞而去除。积聚模与爱根核模的颗粒物合称细粒子。(3)粗粒子模的粒子称为粗粒子,多由机械过程所产生的扬尘、液滴蒸发、海盐溅沫、火山爆发和风沙等一次颗粒物所构成,因此它的组成与地面土壤十分相近,主要靠干沉降和湿沉降过程而去除。15
23.何谓温室效应和温室气体?大气中的某些微量组分,能使太阳的短波辐射透过,加热地面,而地面增温后所放出的热辐射,却被这些组分吸收,使大气增温。由于这些组分的作用在某些方面类似温室的玻璃房顶,因此这种现象被称为温室效应,这些组分被称为为温室气体。主要温室气体有二氧化碳(CO2)、甲烷(CH4)、二氧化氮(NO2)、氯氟烷烃(CFCs)等。八十年代研究表明,人为排放各种温室气体对温室效应所起作用比例不同,其中二氧化碳55%,氯氟烷烃24%,甲烷15%,二氧化氮6%。二氧化碳大量增加是造成温室效应加剧的主要原因。《水环境化学》重点习题及参考答案1.请推导出封闭和开放体系碳酸平衡中[H*-2-2CO3]、[HCO3]和[CO3]的表达式,并讨论这两个体系之间的区别。解:(1)封闭体系(溶解性CO2与大气没有交换)中存在下列平衡CO2+H2OH2CO3*pK0=1.46H2CO3*HCO3-+H+pK1=6.35HCO-2-+3CO3+HpK2=10.33其中K-+2-+-1=[HCO3][H]/[H2CO3*],K2=[CO3][H]/[HCO3]用α0、α1和α2分别表示三种碳酸化合态在总量中所占比例,得下面表达式α-2-0=[H2CO3*]/{[H2CO3*]+[HCO3]+[CO3]}α--2-1=[HCO3]/{[H2CO3*]+[HCO3]+[CO3]}α2--2-2=[CO3]/{[H2CO3*]+[HCO3]+[CO3]}把K1、K2的表达式代入以上三式,得α++2-10=(1+K1/[H]+K1K2/[H])α++-11=(1+[H]/K1+K2/[H])α+2+-12=(1+[H]/K1K2+[H]/K2)设C-2-T=[H2CO3*]+[HCO3]+[CO3],则有[H++2-12CO3*]=CT(1+K1/[H]+K1K2/[H])[HCO-++-13]=CT(1+[H]/K1+K2/[H])[CO2-+2+-13]=CT(1+[H]/K1K2+[H]/K2)(2)开放体系中CO2在气相和液相之间平衡,各种碳酸盐化合态的平衡浓度可表示为PCO2和pH的函数。16
依亨利定律:[CO2(aq)]=KH·PCO2溶液中,碳酸化合态相应为:CT=[CO2]/α0=KH·PCO2/α0[HCO-+3]=(α1/α0)KH·PCO2=(K1/[H])KH·PCO2[CO2-+23]=(α2/α0)KH·PCO2=(K1K2/[H])KH·PCO2(3)比较封闭体系和开放体系可发现,在封闭体系中,[H-2-2CO3*]、[HCO3]、[CO3]等可随pH值变化,但总的碳酸量C-2-T始终不变。而对于开放体系CT、[HCO3]、[CO3]均随pH值改变而变化,但[H2CO3*]总保持与大气相平衡的固定数值。2.请导出总酸度、CO2酸度、无机酸度、总碱度、酚酞碱度和苛性碱度的表达式作为总碳酸量和分布系数(α)的函数3.向一含有碳酸的水体加入重碳酸盐,问:①总酸度、②总碱度、③无机酸度、④酚酞碱度和⑤CO2酸度,是增加、减少还是不变。4.在一个pH为6.5、碱度为1.6mmol/L的水体中,若加入碳酸钠使其碱化,问需加多少mmol/L的碳酸钠才能使水体pH上升至8.0。若用NaOH强碱进行碱化,又需加入多少碱?解:总碱度=KW/[H+]+CT(α1+2α2)-[H+]1C+-T={[总碱度]+[H]-[OH]}12217
1令α=122当pH在5~9范围内、[碱度]≥10-3mol/L时,[H+]、[OH-]项可以忽略不计,得到简化式:CT=α[碱度]当pH=6.5时,查教材P110表得α-51=0.5845,α2=8.669×10,则α=1.71,CT=α[碱度]=1.71×1.6=2.736mmol/L若加入碳酸钠将水的pH升至8.0,查表得α′=1.018,此时C2-T值与碱度值均有变化。设加入的碳酸钠量为Δ[CO3],则有C2-2-T+Δ[CO3]=α′{[碱度]+2Δ[CO3]}即2.736+Δ[CO32-]=1.018{1.6+2Δ[CO32-]}解得,Δ[CO2-3]=1.069mmol/L若加入氢氧化钠将水的pH升至8.0,其CT值并不变化,可得:[碱度]=CT/α′=2.736/1.018=2.688mmol/L碱度增加值就是应加入的氢氧化钠强碱量:Δ[OH-]=2.688-1.6=1.088mmol/L8请叙述水中主要有机和无机污染物的分布和存在形态。18
9什么叫优先污染物?我国优先控制污染物包括哪几类?10请叙述天然水体中存在哪几类颗粒物?11.什么是表面吸附作用、离子交换吸附作用和专属吸附作用?并说明水合氧化物对金属离子的专属吸附和非专属吸附的区别。(1)表面吸附:由于胶体表面具有巨大的比表面和表面能,因此固液界面存在表面吸附作用。胶体表面积越大,吸附作用越强。(2)离子交换吸附:环境中大部分胶体带负电荷,容易吸附各种阳离子。胶体每吸附一部分阳离子,同时也放出等量的其他阳离子,这种作用称为离子交换吸附作用,属于物理化学吸附。该反应是可逆反应,不受温度影响,交换能力与溶质的性质、浓度和吸附剂的性质有关。(3)专属吸附:指在吸附过程中,除了化学键作用外,尚有加强的憎水键和范德化力或氢键作用。该作用不但可以使表面点荷改变符号,还可以使离子化合物吸附在同号电荷的表面上。(4)水合氧化物对金属离子的专属吸附与非金属吸附的区别如下表所示。项目专属吸附非专属吸附发生吸附的表面净电荷的符号-、0、+-金属离子所起的作用配位离子反离子19
吸附时所发生的反应配位体交换阳离子交换发生吸附时要求体系的pH值任意值>零电位点吸附发生的位置内层扩散层对表面电荷的影响负电荷减少,正电荷增加无动力学可逆性不可逆慢过程快速可逆?12.请叙述氧化物表面吸附配合模型的基本原理以及与溶液中配合反应的区别14请说明胶体的凝聚和絮凝之间的区别。由电介质促成的聚集称为凝聚,由聚合物促成的聚集称为絮凝15请叙述水中颗粒物可以哪些方式进行聚集?16请叙述水环境中促成颗粒物絮凝的机理。20请叙述腐殖质的分类及其在环境中的作用。22请叙述有机配体对重金属迁移的影响。20
23什么是电子活度pE,以及它和pH的区别。24有一个垂直湖水,pE随湖的深度增加将起什么变化??34请说明湖泊富营养化预测模型的基本原理。?36叙述有机物水环境归趋模式的基本原理《土壤环境化学》重点习题及参考答案1.土壤由哪些主要成分?它们对土壤的性质与作用有哪些影响?1)土壤矿物质:其是土壤的主要组成部分,占土壤固体总质量的90%,是土壤的骨骼和植物营养元素的重要供给来源,分为原生矿物质与次生矿物质。原生矿物质主要有硅酸盐矿物,氧化物类矿物,硫化物好磷酸盐类矿物。次生矿物质主要有高岭石、蒙脱石、伊利石类,很多重要的物理化学过程和性质都和土壤所含黏土矿物种类和数量有关。2)土壤有机质:一般占土壤固相总质量的10%以下,是土壤的重要组成部分,是土壤形成的重要标志,在土壤肥力、环境保护及农林业可持续发展等方面有重要作用。3)土壤水分:是植物营养的主要来源,也是进入土壤的各种污染物向其他环境圈层迁移的的媒介。4)土壤中的空气:土壤空气使土壤具有疏松的结构。21
2.什么是土壤的活性酸度与潜性酸度?试用它们二者的关系讨论我国南方土壤酸度偏高的原因。根据土壤中H+的存在方式,土壤酸度可分为活性酸度与潜性酸度两大类。(1)活性酸度:土壤的活性酸度是土壤溶液中氢离子浓度的直接反映,又称有效酸度,通常用pH表示。(2)潜性酸度:土壤潜性酸度的来源是土壤胶体吸附的可代换性H+和Al3+。当这些离子处于吸附状态时,是不显酸性的,但当它们经离子交换作用进入土壤溶液后,即可增加土壤溶液的H+浓度,使土壤pH值降低。南方土壤中岩石或成土母质的晶格被不同程度破坏,导致晶格中Al3+释放出来,变成代换性Al3+,增加了土壤的潜性酸度,在一定条件下转化为土壤活性酸度,表现为pH值减小,酸度偏高。3.土壤的缓冲作用有哪几种?举例说明其作用原理。土壤缓冲性能包括土壤溶液的缓冲性能和土壤胶体的缓冲性能:(1)土壤溶液的缓冲性能:土壤溶液中H2CO3、H3PO4、H4SiO4、腐殖酸和其他有机酸等弱酸及其盐类具有缓冲作用。以碳酸及其钠盐为例说明。向土壤加入盐酸,碳酸钠与它生成中性盐和碳酸,大大抑制了土壤酸度的提高。Na2CO3+2HCl2NaCl+H2CO3当加入Ca(OH)2时,碳酸与它作用生成难溶碳酸钙,也限制了土壤碱度的变化范围。H2CO3+Ca(OH)2CaCO3+2H2O土壤中的某些有机酸(如氨基酸、胡敏酸等)是两性物质,具有缓冲作用,如氨基酸既有氨基,又有羧基,对酸碱均有缓冲作用。NH2NH3ClRCH+HClRCHCOOHCOOHNH2NH2RCH+NaOHRCH+HO2COOHCOONa(2)土壤胶体的缓冲作用:土壤胶体吸附有各种阳离子,其中盐基离子和氢离子能分别对酸和碱起缓冲作用。对酸缓冲(M-盐基离子):土壤胶体M+HCl土壤胶体H+MCl对碱缓冲:22
土壤胶体H+MOH土壤胶体M+H2OAl3+对碱的缓冲作用:在pH小于5的酸性土壤中,土壤溶液中Al3+有6个水分子围绕,当OH-增多时,Al3+周围的6个水分子中有一、二个水分子离解出H+,中和OH-:2Al(H3+-4+2O)6+2OH[Al2(OH)2(H2O)8]+4H2O4.什么是盐基饱和度?它对土壤性质有何影响?盐基饱和度:在土壤交换性阳离子中盐基离子所占的百分数成为土壤的盐基饱和度。盐基饱和度越高,土壤对酸的缓冲能力越大;土壤的盐基饱和度越低,土壤对碱的缓冲能力越大。5.试比较土壤阳、阴离子交换吸附的主要作用原理与特点?阳离子交换吸附作用原理:以离子价为为依据,受质量作用定律支配,土壤胶体吸附的阳离子与土壤溶液中的阳离子进行等价交换。阳离子交换吸附作用特点:1离子电荷数越高,阳离子交换能力越强。2同价离子中,离子半径越大,水化离子半径就越小,因而具有较强的交换能力。3土壤中一些常见阳离子的交换能力顺序:Fe3+Al3+H+Ba2+Sr2+Ca2+Mg2+Cs+Rb+NH++++4KNaLi阴离子交换吸附作用原理:带正电荷的胶体所吸附的阴离子与溶液中阴离子进行交换。阴离子交换吸附作用特点:(1)土壤阴离子与胶体微粒或溶液中的阳离子形成难溶性沉淀而被强烈地吸附。(2)各种阴离子被土壤胶体吸附的顺序如下:F->草酸根>柠檬酸根>>硅酸根>CH---3COO>SCN>Cl6.土壤中重金属向植物迁移的主要方式及影响因素有哪些?土壤中重金属向植物迁移的主要方式为跨膜吸收,影响因素主要有土壤的理化性质、重金属种类、浓度及在土壤中的存在形态,植物种类、生长发育期,复合污染,施肥等。(1)土壤的理化性质土壤的理化性质主要通过影响重金属在土壤中存在形态而影响重金属的生物有效性,其主要包括pH、土壤质地、土壤的氧化还原电位、土壤中有机质的含量等。(2)重金属的种类、浓度及在土壤中的存在形态重金属对植物的毒害程度首先取决于土壤中重金属的存在形态,其次才取决于该元素的数量。从总量上来看随着土壤中重金属含量的增加,植物体内各部分的积累量也相应增加。重金属的存在形态可分为交换态、碳酸盐结合态、铁锰氧化物结合态、有机结合态和残渣态,交换态的重金属迁移能力最强,具有生物有效性。(3)植物的种类、生长发育期植物的种类和生长发育期影响着重金属在土壤-植物体系中的迁移转化。植物的种类不同,其对重金属的23
富集规律不同;植物的生长发育期不同,其对重金属的富集量也不同。(4)复合污染在复合污染状况下,影响重金属迁移转化的因素涉及污染物因素(包括污染物的种类、性质、浓度、比例和时序性)、环境因素(包括光、温度、pH、氧化还原条件等)和生物种类、发育阶段及所选择指标等。(5)施肥施肥可以改变土壤的理化性质和重金属的存在形态,并因此而影响重金属的迁移转化。由于肥料、植物和重金属种类的多样性以及重金属行为的复杂性,施肥对土壤-植物体系中重金属迁移转化的影响机制十分复杂。7.植物对重金属污染产生耐性作用的主要机制是什么?不同种类的植物对重金属的耐性不同,同种植物由于其分布和生长的环境各异可能表现出对某种重金属有明显的耐性。(1)植物根系通过改变根系化学性状、原生质泌溢等作用限制重金属离子的跨膜吸收。(2)重金属与植物的细胞壁结合,而不能进入细胞质影响细胞代谢活动,使植物对重金属表现出耐性。(3)酶系统的作用。耐性植物中酶活性在重金属含量增加时仍能维持正常水平,此外在耐性植物中还发现另一些酶可被激活,从而使耐性植物在受重金属污染时保持正常代谢过程。(4)形成重金属硫蛋白或植物络合素,使重金属以不具生物活性的无毒螯合物形式存在,降低了重金属离子活性,从而减轻或解除其毒害作用。8.举例说明影响农药在土壤中进行扩散和质体流动的因素有哪些?(1)影响农药在土壤中扩散的因素主要是土壤水分含量、吸附、孔隙度、温度及农药本身的性质等:①土壤水分含量:研究表明林丹的汽态和非汽态扩散情况随土壤水分含量增加而变化。②吸附:土壤对农药的吸附改变了其扩散的情况,如土壤对2,4-D的化学吸附,使其有效扩散系数降低了,两者呈负相关关系。③土壤紧实度:土壤紧实度对农药的扩散的情况有影响是因为对于以蒸汽形式进行扩散的化合物来说,增加紧实度就降低了土壤孔隙率,扩散系数就自然降低了。如二溴乙烷、林丹等农药在土壤中的扩散系数随紧实度增加而降低。④温度:温度增高的总效应是使扩散系数增大。⑤气流速度:气流速度可直接或间接地影响农药的挥发。如果空气的相对湿度不是100%,那24
么增加气流就促进土壤表面水分含量降低,可以使农药蒸汽更快地离开土壤表面,同时使农药蒸汽向土壤表面运动的速度加快。⑥农药种类:不同农药的扩散行为不同。如有机磷农药乐果和乙拌磷在Broadbalk粉砂壤土中的扩散行为就是不同的。(2)影响农药在土壤中质体流动的因素有农药与土壤的吸附、土壤种类和农药种类等。①农药与土壤吸附:非草隆、灭草隆、敌草隆、草不隆四种农药吸附最强者移动最困难,反之亦然。②土壤种类:土壤有机质含量增加,农药在土壤中渗透深度减小;增加土壤中粘土矿物的含量,农药的渗透深度也减小。③农药种类:不同农药在土壤中通过质体流动转移的深度不同。如林丹和DDT。9.比较DDT和林丹在环境中的迁移、转化与归趋的主要途径与特点。DDT和林丹迁移转化、归趋主要途径与特点比较如下表所示:迁移转化、归趋途径特点1)在土壤中移动不明显,易被吸附1)不溶于水,高亲脂性,易通过2)通过根系渗入植物体食物链放大,积累性强DDT3)在土壤中按还原、氧化和脱氯化2)挥发性小,持久性高氢等机理被微生物降解3)在缺氧和高温时降解速度快4)光解4)南方水田里DDT降解快于北方1)从土壤和空气转入水体1)易溶于水2)挥发而进入大气林丹2)挥发性强,持久性低3)在土壤生物体内积累3)在生物体内积累性较DDT低4)植物积累10.试述有机磷农药在环境中的主要转化途径,并举例说明其原理。有机磷农药在环境中转化途径有非生物降解和生物降解。(1)有机磷农药的非生物降解①吸附催化水解:吸附催化水解是有机磷农药在土壤中降解的主要途径。如地亚农等硫代硫酸酯的水解反应如下SS+H2O(RO)P(RO)2P+R,OH2+-OR,(H或OH)OH②光降解:有机磷农药可发生光降解反应,如辛硫磷在253.7nm的紫外光下照射30小时,其光解产物如下25
OCN(C2H5O)2PSNC(辛硫磷感光异构体)OO(C2H5O)2POP(OC2H5)2(特普)SCN(C2H5O)2PONCOS(辛硫磷)(C2H5O)2PP(OC2H5)2(一硫代特普)OCN(C2H5O)2PONC(辛氧磷)(2)有机磷农药的生物降解有机磷农药在土壤中被微生物降解是它们转化的另一条重要途径。化学农药对土壤微生物有抑制作用。同时,土壤微生物也会利用有机农药为能源,在体内酶或分泌酶的作用下,使农药发生降解作用,彻底分解为CO2和H2O。如马拉硫磷被绿色木霉和假单胞菌两种土壤微生物以不同方式降解,其反应如下:SH2O(CH3O)2PSH+HOCHCOOC2H5CH2COOC2H5SS绿色木霉CH3O(CH3O)2PSCHCOOC2H5PSCHCOOCH25HOCH2COOC2H5CH2COOC2H5SS(CH3O)2PSCHCOOH(CH3O)2PSCHCOOHCH2COOC2H5CH2COOH《生物体内污染物质的运动过程及毒性》重点习题及参考答案1.在试验水中某鱼体从水中吸收有机污染质A的速率常数为18.76h-1,鱼体消除A的速率常数为2.38×10-2h-1;设A在鱼体内起始浓度为零,在水中的浓度可视作不变。计算A在该鱼体内的浓缩系数及其浓度达到稳定浓度95%时所需的时间。26
2.在通常天然水中微生物降解丙氨酸的过程如下,在其括号内填写有关的化学式和生物转化途径名称,并说明这一转化过程将对水质带来什么影响。O2(1)CH3CH(NH2)COOH(3)+(2)(4)(13)(5)(11途径)(12)(6)(10)CO2,H2O(7)(8)(9)解:有关的化学式和生物转化途径如下:(1)CO2;(2)CH3COOH;(3)NH3;(4)CoASH;(5)H2O;(6)CH3COCoASH;(7)CH3COCOOH;(8)H2O;(9)CoASH;(10)(CH-2COOH)2C(OH)COOH;(11)三羧酸循环;(12)NO2;(13)硝化。该过程将氮由不能被植物吸收利用的有机态转化为无机氮,利于植物利用;且此过程是耗氧过程,可能引起水体富营养化,使水质变差。3.比较下列各对化合物中微生物降解的快慢,指出所依据的定性判别规律。NO2OH(1)(2)CH3(CH2)5CH3CH3CH2CH327
CH3SO3NaCH(CH2)3CH3(3)答:(1)硝基苯降解要慢于苯酚,根据取代规律,在芳香族化合物中羟基取代基加快其降解,硝基取代基使其降解减缓。(2)庚烷的降解要快于丙烷,根据链长规律,在一定范围内,碳链越长,降解越快。(3)前者降解要快于后者,根据链分支规律,在烷基苯磺酸盐中,分支程度越大,降解越慢。4.在下列微生物降解烷基叔胺过程的括号内,填写有关的酶名、化学式或转化途径名称。图中有关酶名、化学式和转化途径名称:(1)O++2;(2)NADH+H;(3)NADP;(4)H2O;(5)R3CHO;(6)R1CH2NHR2CH2;(7)加氧酶;(8)R2CHO;(9)NH3;(10)R1CHO;(11)水化酶;(12)R1CH(OH)2;(13)NAD;(14)NADH+H+;(15)R1COOH;(16)脂肪酸β氧化;(17)TCA循环5已知氨氮硝化数学模式适用于某一河段,试从下表中该河段的有关数据,写出这一模式的具体形式。河段设置的断面流经时间(h)氨氮浓度(mg/L)被硝化的氨氮浓度(mg/L)Ⅰ02.860Ⅱ2.372.040.63Ⅲ8.770.152.6528
6.用查阅到的新资料,说明毒物的联合作用。毒物的联合作用分为四类。(1)协同作用,是指联合作用的毒性大于其中各毒物成分单独作用毒性的总和。即是说,其中某一毒物成分能促进机体对其他毒物成分的吸收加强、讲解受阻、排泄迟缓、蓄积增多或产生高毒代谢物等,是混合物毒性增加。如四氯化碳与乙醇,臭氧与硫酸气溶胶等。(2)相加作用,是指联合作用的毒性等于其中各毒物成分单独作用毒性的总和,即其中各毒物成分之间均可按比例取代另一毒物成分,而混合物毒性均无改变。当各毒物成分的化学结构相近、性质相似、对机体作用的部位及机理相同时,其联合作用结果往往呈现毒性相加作用。如丙烯腈与乙腈,稻瘟净与乐果等。(3)独立作用,是指各毒物对机体的侵入途径、作用部位、作用机理等均不相同,因而在其联合作用中各毒物生物学效应彼此无关、互不影响。即独立作用的毒性低于相加作用,但高于其中单项毒物的毒性。如苯巴比妥与二甲苯。(4)拮抗作用,是指联合作用的毒性小于其中各毒物成分单独作用毒性的总和。就是说,其中某一毒物成分能促进机体对其他毒物成分的讲解加速、排泄加快、吸收减少或产生低毒代谢物等,使混合毒性降低。如二氯乙烷与乙醇,亚硝酸与氰化物,硒与汞,硒与镉等。7.试说明化学物质致突变、致癌和抑制酶活性的生物化学作用机理。(1)致突变作用机理:致突变性是指生物体中细胞的遗传性质在受到外源性化学毒物低剂量的影响和损伤时,以不连续的跳跃形式发生了突然的变异。致突变作用发生在一般体细胞时,则不具有遗传性质,而是使细胞发生不正常的分裂和增生,其结果表现为癌的形成。致突变作用如影响生殖细胞而使之产生突变时,就有可能产生遗传特性的改变而影响下一代,即将这种变化传递给子细胞,使之具有新的遗传特性。(2)致癌机理:致癌是体细胞不受控制的生长。其机理一般分两个阶段:第一是引发阶段,即致癌物与DNA反应,引起基因突变,导致遗传密码改变。第二是促长阶段,主要是突变细胞改变了遗传信息的表达,增殖成为肿瘤,其中恶性肿瘤还会向机体其他部位扩展。(3)抑制酶活性作用机理:有些有机化合物与酶的共价结合,这种结合往往是通过酶活性内羟基来进行的;有些重金属离子与含硫基的酶强烈结合;某些金属取代金属酶中的不同金属。29
8.解释下列名词的概念。(1)被动扩散;(2)主动转运;(3)肠肝循环;(4)血脑屏障;(5)半数有效剂量(浓度);(6)阈剂量(浓度);(7)助致癌物;(8)促癌物;(9)酶的可逆和不可逆抑制剂答:(1)被动扩散:脂溶性物质从高浓度侧向低浓度侧,即顺浓度梯度扩散通过有类脂层屏障的生物膜。(2)主动转运:在需要消耗一定代谢能量下,一些物质可在低浓度侧与膜上高浓度特异性蛋白载体结合,通过生物膜,至高浓度侧解离出原物质。(3)肠肝循环:有些物质由胆汁排泄,在肠道运行中又重新被吸收,该现象叫肠肝循环。(4)血脑屏障:脑毛细血管阻止某些物质(多半是有害的)进入脑循环血的结构。(5)半数有效剂量(浓度):毒物引起受试生物的半数产生同一毒作用所需的毒物剂量(浓度)。(6)阈剂量(浓度):在长期暴露毒物下,会引起机体受损害的最低剂量(浓度)。(7)助致癌物:可加速细胞癌变和已癌变细胞增殖成瘤块的物质。(8)促癌物:可使已经癌变细胞不断增殖而形成瘤块。(9)酶的可逆和不可逆抑制剂:抑制剂就是能减小或消除酶活性,而使酶的反应速率变慢或停止的物质。其中,以比较牢固的共价键同酶结合,不能用渗析、超滤等物理方法来恢复酶活性的抑制剂,称为不可逆抑制剂;另一部分抑制剂是同酶的结合处于可逆平衡状态,可用渗析法除去而恢复酶活性的物质,称为可逆抑制剂。9.在水体底泥中有下图所示反应发生,填写图中和有关分解反应中所缺的化学式或辅酶简式。图中的转化对汞的毒性有何影响。30
答:(1)Hg;(2)HgCl++2;(3)CH4;(4)NADH;(5)NAD;(6)HCl;(7)NADH+H;(8)CH+4;(9)HCl;(10)NADH+H;(11)HCl;(12)CH4;(13)C2H6;(14)Hg可溶性无机汞在生物体内一般容易排泄,而烷基汞具有高脂溶性,且在生物体内分解速度缓慢,因而其毒性比可溶性无机汞化合物大10到100倍。图中所示的氯化甲基汞变成金属汞的转化过程,是微生物以还原作用转化汞的主要途径,是降低毒性的过程。?10试简要说明氯乙烯致癌的生化机制和在一定程度上防御致癌的解毒转化途径11.举出一个新的研究实例,说明比较分子力场法在QSAR中的应用。谷妍等应用C0MFA(比较分子力场法)分别研究了112种含氟农药的抗小麦赤酶病活性和对小麦生长的毒性,为研究设计新的更高效、安全的含氟农药提供了有益的参考。所有农药母体酒后中的R1,R2,R3和R4表示不同的供电集团和吸电集团。农药的活性和毒性以抑制率的测量值表示。采用标准键长、键角构建所有化合物分子的初始三维结构;通过计算,在对能量进行优化后选择各分子最低能量构象为其可能的优势构象,并确定后者中各原子净电荷。选取78个化合物作为训练集建立C0MFA模型,余下34个化合物为测试集,检验所建模型对化合物的活性和毒性的预测能力。将训练集所有分子的优势构象,在共有的特征点组合上,即在共有的对受体结合、活性及在空间的相对位置所需的重要官能团上叠合起来,置于一个设定的三维网格内。选用sp3杂化的一价碳正离子作为探针,沿该网格格点移动,计算各分子周围立体势场和静电势场的能值分布,连同对应的活性与毒性测量数据,分别进行偏最小二乘法回归分析,建立有关活性与毒性的两个C0MFA模型,评价模型质量,用等高图形显示模型的结果。与测试集34个含氟化合物的活性与毒性测量值相比较,两个模型预测的标准偏差对极差之比分别是10.4%和6.4%,都具有良好的预测能力。《典型污染物在环境各圈层中的转归与效应》重点习题及参考答案1.为什么Hg2+和CH+3Hg在人体内能长期滞留?举例说明它们可形成哪些化合物?这是由于汞可以与生物体内的高分子结合,形成稳定的有机汞络合物,就很难排出体外。此外,烷基汞具有高脂溶性,且它在生物体内分解速度缓慢(其分解半衰期约为70d),因而会在人体内长期滞留。Hg2+和CH+3Hg可以与羟基、组氨酸、半胱氨酸、白蛋白形成络合物。甲基汞能与许多有机配CSC31
位体基团结合,如—COOH、—NH2、—SH、以及—OH等。2.砷在环境中存在的主要化学形态有哪些?其主要转化途径有哪些?砷在环境中存在的主要化学形态有五价无机砷化合物、三价无机砷化合物、一甲基胂酸及其盐、二甲基胂酸及其盐、三甲基胂氧化物、三甲基胂、砷胆碱、砷甜菜碱、砷糖等。砷的生物甲基化反应和生物还原反应是砷在环境中转化的重要过程。主要转化途经如下:3.试述PCDD是一类具有什么化学结构的化合物?并说明其主要污染来源。(1)PCDD这类化合物的母核为二苯并一对二噁英,具有经两个氧原子联结的二苯环结构。在两个苯环上的1,2,3,4,6,7,8,9位置上可有1-8个取代氯原子,由氯原子数和所在位置的不同可能组合成75种异构体,总称多氯联苯并一对二噁英。其结构式如右:(2)来源:①在焚烧炉内焚烧城市固体废物或野外焚烧垃圾是PCDD的主要大气污染源。例如存在于垃圾中某些含氯有机物,如聚氯乙烯类塑料废物在焚烧过程中可能产生酚类化合物和强反应性的氯、氯化氢等,从而进一步生产PCDD类化合物的前驱物。除生活垃圾外,燃料(煤,石油)、枯草败叶(含除草剂)、氯苯类化合物等燃烧过程及森林火灾也会产生PCDD类化合物。②在苯氧酸除草剂,氯酚,多氯32
联苯产品和化学废弃物的生产、冶炼、燃烧及使用和处理过程中进入环境。③另外,还可能来源于一些意外事故和战争。4.简述多氯联苯(PCBs)在环境中主要分布、迁移与转化规律。(1)分布:由于多氯联苯挥发性和水中溶解度较小,故其在大气和水中的含量较少。近期报导的数据表明,在地下水中发现PCBs的几率与地表水中相当。此外,由于PCBs易被颗粒物所吸附,故在废水流入河口附近的沉积物中,PCBs含量较高。水生植物通常可从水中快速吸收PCBs,其富集系数为1×l04~l×l05。通过食物链的传递,鱼体中PCBs的含量约在l~7mg/kg范围内(湿重)。在某些国家的人乳中也检出一定量的PCBs。(2)迁移:PCBs主要在使用和处理过程中,通道挥发进入大气,然后经干、湿沉降转入湖泊和海洋。转入水体的PCBs极易被颗粒物所吸附,沉入沉积物,使PCBs大量存在于沉积物中。虽然近年来PCBs的使用量大大减少,但沉积物中的PCBs仍然是今后若干年内食物链污染的主要来源。(3)转化:PCBs由于化学惰性而成为环境中持久性污染物,它在环境中主要转化途径是光化学分解和生物转化。PCBs在紫外光的激发下碳氯键断裂,而产生芳基自由基和氯自由基,自由基从介质中取得质子,或者发生二聚反应。PCBs生物降解时,含氯原子数目越少,越容易降解。5.6.表面活性剂有哪些类型?对环境的人体的危害是什么?分类:阴离子表面活性剂,阳离子表面活性剂,两性表面活性剂,非离子表面活性剂。危害:1,使水的感官状况受到影响,出现持久性泡沫;2,造成水体富营养化;3.促进水体中石油和多氯联苯等不溶性有机物的乳化、分散,增加废水处理困难;4,浓度高时破坏生物群。《受污染环境的修复》重点习题及参考答案1.微生物修复所需的环境条件是什么?微生物修复技术是指通过微生物的作用清除土壤和水体中的污染物,或是使污染物无害化的过程。它包括自然和人为控制条件下的污染物降解或无害化过程。在自然修复过程(naturalattenuation)中,利用土著微生物(indigenousmicroorganism)的降解能力,但需要有以下环境条件:①有充分和稳定的地下水流;②有微生物可利用的营养物;③有缓冲pH的能力;④有使代谢能够进行的电子受体。如果缺少一项条件,将会影响生物修复的速率和程度。特别是对于外来化合物,如果污染新近发生,很少会有土著微生物能降解它们,所以需要加入有降解能力的外源微生物(exogenousmicroorganism)。33
2.请列举几种强化微生物原位修复技术。原位强化修复技术包括生物强化法、生物通气法、生物注射法、生物冲淋法及生物翻耕法等。(1)生物强化法是指在生物处理体系中投加具有特定功能的微生物来改善原有处理体系的处理效果,如对难降解有机物的去除等。投加的微生物可以来源于原来的处理体系,经过驯化、富集、筛选、培养达到一定数量后投加,也可以是原来不存在的外源微生物。(2)生物通气法(bioventing)用于修复受挥发性有机物污染的地下水水层上部通气层(VadoseZone)土壤。这种处理系统要求污染土壤具有多孔结构以利于微生物的快速生长。另外,污染物应具有一定的挥发性,亨利常数大于1.01325Pa·m3·mol-1时才适于通过真空抽提加以去除。生物通气法的主要制约因素是影响氧和营养物迁移的土壤结构,不适的土壤结构会使氧和营养物在到达污染区之前被消耗。(3)生物注射法(biosparging)又称空气注射法,这种方法适用于处理受挥发性有机物污染的地下水及上部土壤。处理设施采用类似生物通气法的系统,但这里的空气是经过加压后注射到污染地下水的下部,气流加速地下水和土壤有机物的挥发和降解。也有人把生物注射法归入生物通气法。(4)生物冲淋法(bioflooding)将含氧和营养物的水补充到亚表层,促进土壤和地下水中的污染物的生物降解。生物冲淋法大多在各种石油烃类污染的治理中使用,改进后也能用于处理氯代脂肪烃溶剂,如加入甲烷和氧促进甲烷营养菌降解三氯乙烯和少量的氯乙烯。(5)土地耕作法(landfarming)就是对污染土壤进行耕犁处理。在处理过程中施加肥料,进行灌溉,施加石灰,从而尽可能为微生物代谢污染物提供一个良好环境,使其有充足的营养、水分和适宜的pH值,保证生物降解在土壤的各个层面上都能发生。3.请列举几种强化微生物异位修复技术。异位生物修复主要包括堆肥法、生物反应器处理、厌氧处理。(1)堆肥法(composting)是处理固体废弃物的传统技术,被用于受石油、洗涤剂、多氯烃、农药等污染土壤的修复处理,取得了很好的处理效果。堆肥过程中,将受污染土壤与水(达到至少35%含水量)、营养物、泥炭、稻草和动物肥料混合后,使用机械或压气系统充氧,同时加石灰以调节pH。经过一段时间的发酵处理,大部分污染物被降解,标志着堆肥完成。经处理消除污染的土壤可返回原地或用于农业生产。堆肥法包括风道式堆肥处理、好气静态堆肥处理和机械堆肥处理。(2)生物反应器处理(bioreactor)是把污染物移到反应器中完成微生物的代谢过程。这是一种很有价值和潜力的处理技术,适用于处理地表土及水体的污染。生物反应器包括土壤泥浆生物反应器(soilslurrybioreactor)和预制床反应器(preparedbedreactor)。(3)厌氧处理对某些具有高氧化状态的污染物的降解,如三硝基甲苯、多氯取代化合物(PCBs等)等,比耗氧处理更为有效。但总的来说,在生物修复中好氧方法的使用要比厌氧方法广泛得多。主要原因是,严格的厌氧条件难于达到,厌氧过程中会产生一些毒性更大、更难降解的中间代谢产34
物。此外,厌氧发酵的终产物H2S和CH4也存在毒性和风险。4.植物修复重金属的主要过程是什么?根据其作用过程和机理,重金属污染土壤的植物修复技术可分为3种类型。(1)植物提取:利用重金属超积累植物从土壤中吸取一种或几种重金属,并将其转移、储存到地上部分,随后收割地上部分并集中处理,连续种植这种植物,即可使土壤中重金属含量降低到可接受的水平。所谓超积累植物(hyperaccumulator),是指对重金属的吸收量超过一般植物100倍以上的植物,超积累植物积累的Cr、Co、Ni、Cu、Pb含量一般在110mg/kg(干重)以上,积累的Mn、Zn含量一般在10mg/kg(干重)以上。超积累植物从根际吸收重金属,并将其转移和积累到地上部,这个过程中包括许多环节和调控位点:①跨根细胞质膜运输;②根皮层细胞中横向运输;③从根系的中柱薄壁细胞装载到木质部导管;④木质部中长途运输;⑤从木质部卸载到叶细胞(跨叶细胞膜运输);⑥跨叶细胞的液泡膜运输。在组织水平上,重金属主要分布在表皮细胞、亚表皮细胞和表皮毛中;在细胞水平,重金属主要分布在质外体和液泡。(2)植物稳定:利用耐重金属植物的根际的一些分泌物,增加土壤中有毒金属的稳定性,从而减少金属向作物的迁移,以及被淋滤到地下水或通过空气扩散进一步污染环境的可能性。其中包括沉淀、螯合、氧化还原等多种过程。(3)植物挥发:利用植物的吸收、积累和挥发而减少土壤中一些挥发性污染物,即植物将污染物吸收到体内后将其转化为气态物质,释放到大气中,目前这方面研究最多的是类金属元素汞和非金属元素硒。8.请说明臭氧与有机污染物反应的主要机理。(1)臭氧分子的直接氧化反应臭氧的分子结构呈三角形,中心氧原子与其它两个氧原子间的距离相等,在分子中有一个离域π键,臭氧分子的特殊结构使得它可以作为偶极试剂、亲电试剂和亲核试剂。与有机物的直接反应机理可以分为三类:①打开双键发生加成反应。由于臭氧具有一种偶极结构,因此可以同有机物的不饱和键发生1,3偶极环加成反应,形成臭氧化的中间产物,并进一步分解形成醛、酮等羰基化合物和水。例如:R1C=CR2+O3→R1C(-OOH,G)+R2C=O式中的G代表OH,OCH3,OC(O)CH3基②亲电反应亲电反应发生在分子中电子云密度高的点。对于芳香族化合物,当取代基为给电子基团(—OH,—NH2等)时,它与邻位或对位碳具有高的电子云密度,臭氧化反应发生在这些位置上;当取代基35
是吸电子基团(如—COOH,—NO2等)时,臭氧化反应比较弱,反应发生在这类取代基的间位碳原子上,进一步与臭氧反应则形成醌打开芳环,形成带有羰基的脂肪族化合物。③亲核反应亲核反应只发生在带有吸电子基团的碳原子上。分子臭氧的反应具有极强的选择性,仅限于同不饱和芳香族或脂肪族化合物或某些特殊基团发生反应。(2)自由基的反应臭氧在碱性环境等因素作用下,产生活泼的自由基,主要是羟基自由基(•OH),与污染物反应。臭氧在催化条件下易于分解形成•OH,土壤中天然存在的金属氧化物(α-Fe2O3),MnO2和Al2O3通常可以作为这种催化反应的活性位点。因此,臭氧气体能直接或通过在土壤中形成•OH迅速氧化土壤中的许多有害污染物,使它们变得易于生物降解或者变成亲水性的无害化合物。进一步的研究发现,臭氧的氧化作用可以增大土壤中的小分子酸的比例和有机质的亲水性,并通过改变土壤颗粒的结构,促进有机污染物从土壤的脱附,从而提高有机物被生物降解的可能性。然而,臭氧的作用也会由于以下因素而受到限制,例如土壤有机质的竞争反应、土壤湿度、渗透性和pH值等。要提高臭氧的氧化速率和效率,必须采取其它措施促进臭氧的分解而产生活泼的羟基自由基。11.写出Fe-PRB去除重金属的主要机理。以零价铁为反应活性填料的PRB占整个技术的70%,它可以用于可还原有机污染物、可还原无机阴离子,如硫酸根及硝酸根,及重金属的去除。它的反应机理非常复杂,包括还原降解;还原沉淀(沉积);吸附;共沉淀;表面络合等化学过程。很多场合,即使是对一种污染物,也是多种过程同时起作用。零价铁PRB技术用于重金属去除最成熟的是对Cr、U和Tc的去除,有较多实际应用的工程实例,去除原理为还原沉淀。以Cr为例,生成的三价铬,形成氢氧化铬沉淀以及与铁离子形成氢氧化物共沉淀。Fe0+CrO2--4+4H2O=FexCr1-x(OH)3(x≤1)+5OH零价铁作用于重金属其它主要的机理为吸附和共沉淀,零价铁在水中放置过程中,逐渐发生腐蚀反应,生成多种形式的铁的(氢)氧化物沉淀,这些新生的沉淀具有高度反应活性,并具有巨大表面积,可以吸附截留水中的重金属离子。从热力学角度出发,零价铁对重金属的去除还应包括还原沉积途径,如铜离子可与零价铁发生如下反应:Cu2++Fe0=Fe2++Cu0。36'
您可能关注的文档
- 《物理学》李寿松 胡经国 主编 习题解答 一到十二章全部答案.doc
- 《物理学》第五版习题解答-电磁学篇之磁学.pdf
- 《物联网导论》习题解答.docx
- 《物联网工程概论》习题及思考题答案.doc
- 《物联网技术与运用》选择、判断题答案(以此为准).doc
- 《物联网技术与运用》选择判断题答案.doc
- 《特殊需要学生的融合教育》总论第一章练习题及答案.doc
- 《环境化学》(戴树桂 第二版)课后部分习题解答和重要知识点.doc
- 《环境化学》戴树桂(完整版)_课后习题答案.doc
- 《环境化学》戴树桂(第二版)_课后习题答案.pdf
- 《环境化学》戴树桂(第二版)课后习题答案.doc
- 《现代企业管理学》习题答案.doc
- 《现代企划》课后习题答案.docx
- 《现代微型计算机原理与接口技术》课后答案-Xx.pdf
- 《现代控制理论》刘豹著(第3版)课后习题答案(最完整版).pdf
- 《现代教育理论》学生网络习题答案.doc
- 《现代检测技术及仪表》第2版习题解答(孙传友编).doc
- 《现代检测技术及仪表》第2版习题解答.doc